Den uheldige damen
En eldre dame kommer til operasjon for hoftebrudd. Fra tidligere har hun en alvorlig «low flow, low gradient» aortastenose, KOLS og alvorlig pulmonal hypertensjon med beregnet sPAP 80 mmHg for 3 uker siden. Høyre ventrikkel var ikke dilatert.
Hun blir forsiktig bedøvet med et spinalkateter, får 1 SAG og 2L Ringer, og det er lite blodtap fra operasjonen. Blodtrykket er stabilt med noradrenalin og vasopressin.
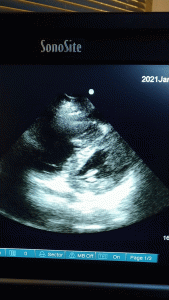
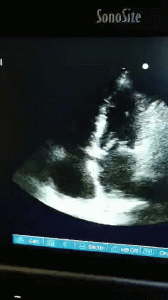
Hun møter meg på postoperativen. Av en uforklarlig grunn har hun økende pressordoser for å holde et adekvat blodtrykk. Hun har fått en CVK, så jeg tar en sentralvenøs blodgass. ScvO2 er 40%; alvorlig lavt og et tegn på hypoperfusjon. Jeg setter ekkoproben på henne og ser dette:
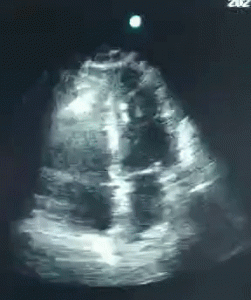
En dilatert høyre ventrikkel, D-formet septum med unormal bevegelse og dilatert IVC. Nyoppstått siden undersøkelsen for 3 uker siden.
Alle pilene peker nå i samme retning: kardiogent sjokk fra en dekompensert høyre ventrikkel. Sannsynlig årsak: iatrogen volum overload.
«↓BT = væske og noradrenalin»
Hypotensjon er en daglig trussel som vi behandler det med væske og noradrenalin. Av alle med sjokk utgjør hypovolemi og distributiv sjokk over 80%, i følge en artikkel fra NEJM. Innen anestesi er andelen kanskje enda større, da våre teknikker konsekvent påfører vasodilatasjon og redusert stresset volum. Å reagere på hypotensjon med væske og noradrenalin er lettvindt og ofte riktig.
Problemet med mentale snarveier er at de er sårbar for feil. Når feilene skjer i kontekst av sjokk blir konsekvensene store: en dødelig årsak for sjokk er udiagnostisert, og tiltakene man gjør kan være direkte skadelige.
«Hvis man alltid gjør som man alltid har gjort, vil man alltid få det man alltid har fått.»
Det vi alltid gjør: væske og noradrenalin med blodtrykk som eneste monitorering.
Det vi får: feildiagnostikk og påført skade.
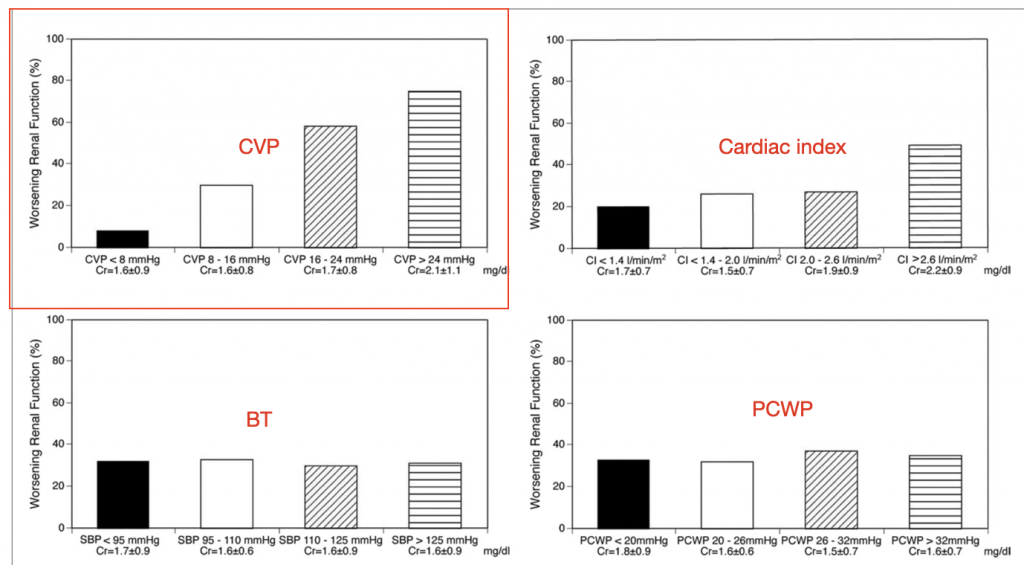
Verdien av CVP-monitorering
CVP har fått mye hets etter at vi innså dens uavhengighet fra volumstatus og fluid responsiveness. Men, CVP er fremdeles en viktig hemodynamisk markør. De uvanlige sjokktypene som overses av den mentale snarveien – kardiogent og obstruktivt sjokk – vil oppdages av en høy CVP. Men CVP forteller oss mer enn det.
Høy CVP er skadelig
En høy CVP er et netto resultatet av høyt intrapleural trykk, buktrykk, volum overload og nedsatt hjertefunksjon. Med hjertefunksjon så menes ikke bare «EF», men alt som påvirker hjertets funksjon, inkl. diastolisk funksjon, klaffefunksjon, arrytmi osv.
Uansett årsak til høy CVP – fra benigne årsaker som PEEP, til maligne årsaker som massiv lungeemboli – er dets effekt på organene det samme: stuvning og hypoperfusjon, hvor nyrene generelt er mest sårbare.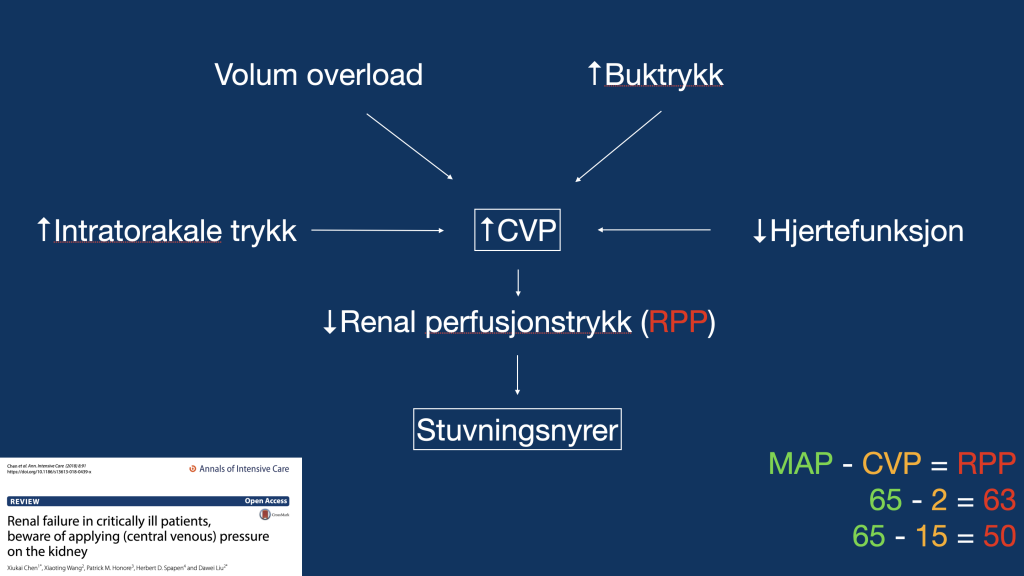
Perfusjonstrykket til et organ kan tenkes å være MAP – CVP, med mindre organlosjen har høyere trykk enn CVP. En MAP-grense på 65 ignorerer CVP, men er sannsynligvis greit da fysiologisk CVP er lavt (0-5). Da er renal perfusjonstrykk (RPP) = MAP – CVP = 65 – 2 = 63. Ved patologi med høy CVP går perfusjonstrykket drastisk ned. f.eks. 65 -15 = 50. Arteriekranen vil aldri vil fange opp denne tilstanden.
Hvordan tolke en høy CVP?
Utelukk kardiogent og obstruktiv sjokk med klinikk og ultralyd av hjerte og lunger. Tenk også på buktrykk og ventilatoren. Ellers er den skadelige effekten klar; stuvning. Parallellt med stuvning kommer også volum intoleranse.
Volum intoleranse
Volum intoleranse er antitesen til fluid responsivenss, der fluid responsiveness er sannsynligheten for væskens nytte og volum intoleranse sannsynligheten for væskens skade. Typiske tilstander er endoteliopati og hjertesvikt. Ved tilstander som endoteliopati kan man være samtidig fluid responsive og volum intolerant. Andre tegn enn en høy CVP kan være en positiv væskebalanse, dilatert IVC, ødem og utseende på CVP-kurven.
CVP-kurven og volum intoleranse
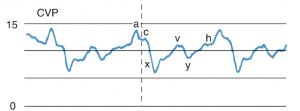
Utseende på CVP-kurven kan også gi viktig info. Det er tre viktige tegn som forteller om høyre ventrikkels diastoliske funksjon og henholdsvis volum intoleranse.
Kort om den normale CVP-kurven (fra Miller’s anesthesia):
- a-bølgen: atriekontraksjon.
- c-bølgen (R-takken på EKG): trikuspidklaffen lukkes og klasker inn i atriet.
- x-descent: atrierelaksering og langaksebevegelse av hjertet.
- v-bølgen: siste fylning av atriet.
- y-descent: fylning av høyre ventrikkel.
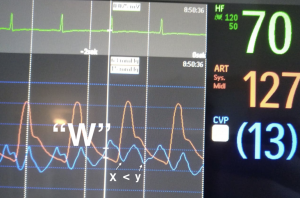
1. x < y-descent
Mekanisme: Redusert trykkfall i atriet under ventrikkelsystole.
Årsaker:
- Høyre ventrikkelsvikt: nedsatt langaksefunksjon (TAPSE) fører til mindre trykkfall.
- Trikuspidinsuffisiens: retrograd fylning reduserer venøs retur.
- Volum overload – venøs retur tas ikke unna før neste syklus.
Høye instiller på respirator, fått mye væske. Ustabil. x < y-descent. Merk også stor a-bølge, som reflekterer nedsatt compliance i atriet. Ekko viser høyre ventrikkelsvikt: Dilatert høyre og nedsatt TAPSE (14mm).
2. «M» eller «W»-morfologi
Mekanisme: Maksimal preload er nådd der nedsatt compliance gjør at trykkene utlignes raskt og kurvene blir spisse.
Årsaker:
- Høyre ventrikkelsvikt: akutt dilatasjon begrenses til slutt av perikard.
- Restriktiv kardiomyopati: stiv hjertemuskel skaper samme fysiologi.
- Intratorakal trykk/volum: perikard begrenses utenifra.
- Konstriktiv perikarditt: den klassiske, men sjeldne årsaken.
Jeg gikk forbi denne mistenkelige kurven på intensiven. Pasienten lå på respirator, hadde nedsatt TAPSE og positiv væskebalanse.
I en mini-kasus diskuteres enda et eksemepl på x < y-descent pluss»W»-morfologi.
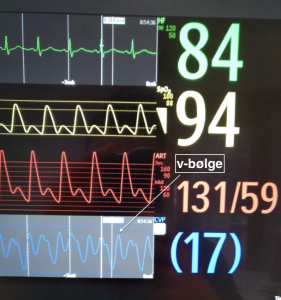
3. Positiv v-bølge
Årsaker:
- Trikuspidinsuffisiens: retrograd jet skaper en positiv bølge, i verste fall en holosystolisk c-v-bølge.
- Hyperdynamisk venøs retur: rikelig venøs retur «kræsjer» inn i en lukket trikuspidklaff og skaper en positv bølge.
Denne pasienten har cirrhose og infeksjon. Cirrotisk sirkulasjon er preget av hypervolemi og vasodilatasjon. Hjertet var hyperdynamisk med VTI 29 og TAPSE 30mm. Ingen åpenbar TI. Jeg tror den positive v-bølgen representerer hyperdynamisk venøs retur.
Kort oppsummert: CVP er verdifullt
- CVP passer på blodtrykkets blindsoner.
- Høy CVP er skadelig.
- CVP forteller om volum intoleranse.
Hvordan gikk det med den uheldige damen?
Tilstanden er var preget av ventrikulær gjensidighet hvor høyre ventrikkel tar plassen til venstre. Hun fikk diuretika, på tross av økende pressordoser. Dagen etter kunne noradrenalin trappes ut og hun fikk på sengepost.
Igjen og igjen ser vi at blodtrykk alene er utilstrekkelig overvåking. Kanskje ville CVP-monitorering ha forebygget volum overload og dekompensering av en sårbar høyre ventrikkel.
(Bildet stjelt fra Absurdgalleriet)